La corrosión galvánica
desde tiempos remotos se conoce como la interacción de dos materiales disímiles,
se presenta en materiales que se usan en forma de aleaciones, estas aleaciones
generalmente traen consigo cambio de las propiedades metalúrgicas y debido a
esto se generan unos cambios en las propiedades electroquímicas.
Objetivos
Hallar
la velocidad de deterioro en mpy (milipulgadas por año).
Diagnosticar
el impacto del área del cátodo y del ánodo sobre la erosión.
Procedimiento experimental
Para elaborar este experimento, se requiere preparar
1 L de solución de NaCl 1 N. Se debe realizar el montaje de una celda
electroquímica. Es necesario utilizar electrodos de hierro y cobre de
diferentes áreas. Luego se conecta la celda electroquímica a un multímetro y se
revisa el circuito. Es fundamental disminuir el valor de la resistencia
eléctrica. Se registran los datos de las corrientes y los potenciales
individuales de cada electrodo con las diferencias de potencial respectivas.
Registro fotográfico
 |
| Fig. 1. Circuito de la celda |
 |
Fig. 2. Forma de los electrodos
|
Saturado con oxígeno
SISTEMA 1. Fe
(Pequeño-Ánodo)-Cu (Grande-Cátodo)
|
||||||
E-Fe
|
E-Cu
|
Corriente
|
i-Fe
|
i-Cu
|
Fe
|
Cu
|
(mV)
|
(mV)
|
(uA)
|
(μA/cm2)
|
(μA/cm2)
|
Log i
|
Log i
|
-411
|
-633
|
0
|
0
|
0
|
0
|
0
|
-427
|
-767
|
1
|
2
|
1
|
0.30103
|
0
|
-431
|
-695
|
5
|
10
|
5
|
1
|
0.69897
|
-430
|
-728
|
10
|
20
|
10
|
1.30103
|
1
|
-442
|
-522
|
32
|
64
|
32
|
1.80617997
|
1.50514998
|
-451
|
-447
|
59
|
118
|
59
|
2.07188201
|
1.77085201
|
-482
|
-344
|
105
|
210
|
105
|
2.32221929
|
2.0211893
|
-540
|
-164
|
174
|
348
|
174
|
2.54157924
|
2.24054925
|
-636
|
-84
|
520
|
1040
|
520
|
3.01703334
|
2.71600334
|
I
corrosión=58.99
SISTEMA 2. Áreas Iguales de Fe y Cu
|
||||
E-Fe
|
E-Cu
|
Corriente
|
i-Fe=i-Cu
|
Fe=Cu
|
(mV)
|
(mV)
|
(μA)
|
(μA/cm2)
|
Log i
|
-419
|
-70.9
|
0
|
0
|
0
|
-413
|
-73.3
|
1
|
1
|
0
|
-412
|
-75.9
|
10
|
10
|
1
|
-407
|
-90.4
|
27
|
27
|
1.43136376
|
-399
|
122.2
|
43
|
43
|
1.63346846
|
-392
|
170.9
|
55
|
55
|
1.74036269
|
-381
|
-297
|
102.5
|
102.5
|
2.01072387
|
-371
|
-417
|
150
|
150
|
2.17609126
|
I
corrosión=102.50
SISTEMA 3. Fe
(Ánodo-Grande)-Cu (Cátodo-Pequeño)
|
||||||
E-Fe
|
E-Cu
|
Corriente
|
i-Fe
|
i-Cu
|
Fe
|
Cu
|
(mV)
|
(mV)
|
(μA)
|
(μA/cm2)
|
(μA/cm2)
|
Log i
|
Log i
|
-450
|
-95.3
|
0
|
0
|
0
|
0
|
0
|
-470
|
-93.8
|
1
|
1
|
2
|
0
|
0.30103
|
-479
|
-99.8
|
5
|
5
|
10
|
0.69897
|
1
|
-483
|
-105.1
|
10
|
10
|
20
|
1
|
1.30103
|
-490
|
-125.3
|
20
|
20
|
40
|
1.30103
|
1.60205999
|
-490
|
-175.9
|
41
|
41
|
82
|
1.61278386
|
1.91381385
|
-490
|
-298.3
|
91
|
91
|
182
|
1.95904139
|
2.26007139
|
-490
|
-377
|
122
|
122
|
244
|
2.08635983
|
2.38738983
|
-484
|
-499
|
245
|
245
|
490
|
2.38916608
|
2.69019608
|
-542
|
-450
|
250
|
250
|
500
|
2.39794001
|
2.69897
|
-476
|
-611
|
450
|
450
|
900
|
2.65321251
|
2.95424251
|
I
corrosión=490
Saturado con nitrógeno
Sistema 4. Áreas iguales
Fe y Cu
|
|||
i
|
Log i
|
Fe (mV)
|
Cu (mV)
|
0
|
-0.542
|
-0.2275
|
|
5
|
0.69897
|
-0.536
|
-0.2623
|
10
|
1
|
-0.537
|
-0.2893
|
20
|
1.30103
|
-0.536
|
-0.334
|
27
|
1.43136376
|
-0.539
|
-0.414
|
40
|
1.60205999
|
-0.54
|
-0.525
|
46,8
|
1.67024585
|
-0.54
|
-0.575
|
67
|
1.8260748
|
-0.537
|
-0.655
|
I
corrosión=1.62
SISTEMA 5. Fe
(Grande -Ánodo)-Cu (Pequeño-Cátodo)
|
||||||
E-Fe
|
E-Cu
|
Corriente
|
i-Fe
|
i-Cu
|
Fe
|
Cu
|
(mV)
|
(mV)
|
(uA)
|
(μA/cm2)
|
(μA/cm2)
|
Log i
|
Log i
|
-600
|
-1448
|
0
|
0
|
0
|
0
|
0
|
-623
|
-2279
|
7.19
|
7.19
|
14.38
|
0.85672889
|
1.15775889
|
-625
|
-2186
|
9.96
|
9.96
|
19.92
|
0.99825934
|
1.29928933
|
-627
|
-2082
|
17.07
|
17.07
|
34.14
|
1.23223352
|
1.53326352
|
-630
|
-1902
|
29.05
|
29.05
|
58.1
|
1.46314614
|
1.76417613
|
Cálculo de la velocidad de corrosión en mpy del ánodo en cada celda electroquímica
Cobre,
densidad: 8.96 g/cm3 Peso
atómico: 63.54 g/mol
Hierro,
densidad: 7.86 g/cm3 Peso
atómico: 55.847 g/mol
a = Peso
atómico
i = Densidad
constante en µA/cm2
D
= Densidad en g/cm3
n = Número de
equivalentes de intercambio “carga”
SISTEMA 1: Fe grande
(ánodo) - Cu pequeño (cátodo)
SISTEMA 2: Fe – Cu (áreas iguales)
I corrosión=102.50
SISTEMA 3: Fe pequeño- Cu grande
I corrosión=58.99
SISTEMA 4: Fe- Cu (áreas iguales
saturadas con nitrógeno)
I corrosión=1.62
Al cambiar la
concentración, la velocidad de reacción va a variar produciendo un aumento o
disminución de la misma, porque si aumenta la conductividad hay mayor
transporte de iones lo cual genera el aumento de la velocidad de corrosión y
cuando la conductividad disminuye, la velocidad de corrosión también lo hace, debido
a que hay menor paso de iones; esta definición está basada en que la conductividad
de una solución tiene la capacidad de pasar cargas a través de él.
Cuando el sistema está
desaireado, se puede generar una disminución de la velocidad de corrosión
debido a que gracias a la presencia de oxígeno puede generar la capa pasiva
generando esa disminución de la velocidad de corrosión. En un sistema
desaireado genera un aumento de la velocidad de corrosión. Cuando un material
entra en contacto con una solución rica en oxígeno, se protege actuando como cátodo,
mientras que las superficies en soluciones pobres en oxígeno se comportan como
ánodos o tienden a una mayor corrosión.
Conclusiones
Se observó
directamente los diferentes efectos de la corrosión por par galvánico.
Cuando se tienen áreas
iguales, se observa una mayor I de corrosión, esto se debe a que por la
igualdad en el área, no influye el efecto del área y por lo tanto se va a
corroer sin limitaciones.
Cuando el área del
hierro es menor se observa un aumento del I de corrosión, pero no es el mayor
debido a que en el sistema el cátodo es pequeño y el ánodo es grande por lo
cual hay un exceso de consumo de electrones y casi no hay corrosión.
Se observó que en
el proceso de par galvánico o corrosión galvánica, es efectivo en presencia de
dos metales con una diferencia de potencial o de materiales diferentes unidos y
en un medio corrosivo electrolítico; en dicho caso, el hierro se comporta como ánodo
y el cobre como cátodo.
Bibliografía
Jones, Denys A. Principles and Prevention of Corrosion, Second Edition. Prentice Hall.
Fonteira M. Greene N. Corrosion Engineering. Mc Graw Hill Book Company.
José Salomón Boha. Ingeniería de Corrosión. Instituto Nacional del Acero.










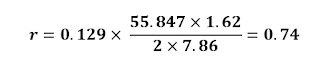
No hay comentarios.:
Publicar un comentario
Cualquier duda, comentario, inquietud o sugerencia, no dudes en contactarme.