La técnica de protección catódica se utiliza para
controlar la corrosión de estructuras metálicas subterráneas y submarinas, como
las tuberías de petróleo y gas, las líneas de servicios públicos y los
cimientos estructurales.
Actualmente, la protección catódica es ampliamente
aplicada en la protección de plataformas de perforación de petróleo, muelles,
barcos, submarinos, tubos intercambiadores de calor, puentes y cubiertas, y
diferentes medios de transporte (aéreo, vial, marítimo)
El diseño de sistemas de protección catódica es muy
complejo, sin embargo está basado en un principio electroquímico simple, de
modo que la corriente fluye entre los ánodos y cátodos de acción local, debido
a la diferencia de potencial entre ellos ocasionando que los electrones liberados
en una reacción anódica sean consumidos en una reacción catódica, entonces si
se suministra mayor cantidad de electrones por la aplicación de corriente
directa, el potencial catódico se desplaza hacia el potencial anódico, y la reacción
catódica incrementaría, mientras que la reacción anódica decrecería minimizando
o eliminando la corrosión por la disminución o eliminación de la diferencia de
potencial, justo cuando el valor del potencial catódico iguala el valor del potencial
anódico.
Para tener éxito al controlar la corrosión, se debe demostrar
la efectividad de la protección catódica con ánodos de sacrificio mediante la
determinación del potencial de la estructura.
Es indispensable evaluar la efectividad de la
protección catódica aplicada, comparando los potenciales obtenidos con el
potencial de protección del electrodo de trabajo.
Finalmente, se debe hacer un análisis del fenómeno que
ocurre en los ánodos de sacrificio de cada experimento.
Los materiales requeridos para aplicar la protección
catódica en un laboratorio son los siguientes:
a) Caja metálica (60 cm × 55 cm × 35 cm).
b) Potenciómetro.
c) Cuatro electrodos de magnesio.
d) Solución de NaCl 1 N: 58.5 g de NaCl por cada 1000
mL de agua.
e) Electrodo de referencia Calomel.
f) Bafle de madera.
Para desarrollar el
experimento se debe realizar un procedimiento adecuado. Primero se debe pulir
la caja metálica con material de desbaste. Luego, se deposita la solución de
NaCl 1 N (Normal) en la caja metálica. Posteriormente, se mide el potencial en varios
puntos de las aristas o caras de la caja metálica, se utiliza un electrodo de
referencia y se comparan las diferencias de potencial. El electrodo de
referencia se debe ubicar en una esquina de la caja, posteriormente se miden
los potenciales 2 veces en las esquinas.
Se debe ubicar un bafle transversal
de la caja y medir nuevamente los potenciales. Una vez hecho esto, se retiran
los electrodos de magnesios y se miden los potenciales. Finalmente se hace un
análisis detallado de los resultados obtenidos.
Resultados
 |
Fig. 1. Ánodos de sacrificio de magnesio que son
ubicados en las esquinas del tanque metálico.
|
 |
| Fig. 3. Medición del potencial en los puntos predeterminados, con ánodos de sacrificio instalados y sujetos con barras de madera. |
Capacidad del tanque
Largo
60 cm, ancho 55 cm y alto 35.2 cm, entonces tiene un volumen de
V= 60
× 55 ×35.2 = 116160 cm3.
Cantidad de sal para una solución de NaCl 1 N:
Si 58.5
g NaCl se requieren para 1 L de solución, entonces para 116 L se necesitan: X=
(58.5 g de NaCl × 116 L)/ 1 L= 6786 g de NaCl, es decir 13 libras de sal
aproximadamente.
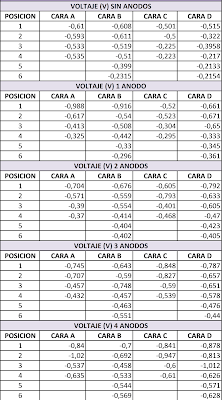 |
Fig.
4. Tablas de voltajes
|
El
bafle es la placa utilizada para dirigir o controlar el movimiento de un fluido
dentro de un área confinada, también se conoce como deflector. Su efecto es
actuar como una resistencia, que afecta el paso de la corriente presente en
electrolito y afecta el sistema.
Se acepta comúnmente
que si el potencial del hierro ha trabajado hasta -0.85 V Vs. el electrodo Cu/CuSO4
el metal se encuentra completamente protegido. Puede justificarse este valor
teóricamente.


No hay comentarios.:
Publicar un comentario
Cualquier duda, comentario, inquietud o sugerencia, no dudes en contactarme.